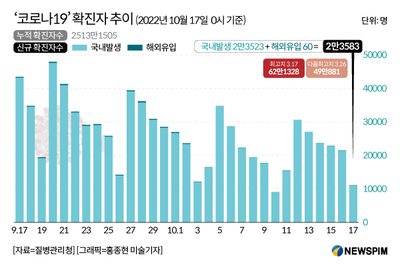
[세종=뉴스핌] 이경화 기자 = 식품의약품안전처가 17일 한국화이자제약의 코로나19 오미크론 변이 대응 백신 '코미나티2주 0.1mg/mL'에 대한 긴급사용 승인을 결정했다.
이번에 긴급사용승인한 백신은 코로나19 초기 바이러스와 변이 바이러스(오미크론주, BA.4·BA.5 공통부분) 각각의 항원을 발현하는 mRNA(메신저리보핵산)를 주성분으로 하는 2가 백신이다. 12세 이상의 코로나19 예방을 목적으로 하며 기초접종이나 추가접종을 받은 후 3개월이 지났을 때 0.3mL를 추가 접종한다.
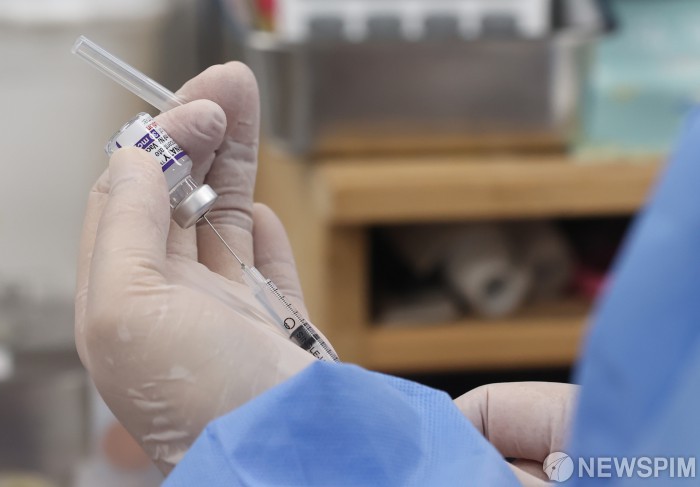 |
| [서울=뉴스핌] 김민지 기자 = 50대와 18세 이상 성인 기저질환자에 대한 코로나19 백신 4차 접종이 시작된 18일 오전 서울 종로구보건소에서 의료진이 백신 접종 준비를 하고 있다. 4차 접종은 카카오톡·네이버에서 잔여 백신을 예약하거나 의료기관의 예비 명단을 활용해 접종 받을 수 있다. 2022.07.18 kimkim@newspim.com |
앞서 식약처는 한국화이자제약이 제출한 자료를 근거로 효과성과 안전성을 검토하고 중앙약사심의위원회(중앙약심)를 열어 감염내과, 병리학, 예방의학 등 다양한 분야 전문가 13인에 자문했다.
중앙약심에서 전문가들은 신청사가 제출한 자료가 미국과 유럽이 BA.4·5 대응 백신을 검토하기 위해 활용한 자료와 동일하고, 우리나라가 해당 자료에 기반해 긴급사용승인하는 것이 가능하다는 의견을 냈다.
또 BA.4·5 대응 2가 백신이 그간 허가받은 화이자 코로나19 백신과 mRNA 플랫폼, 투여 용량, 제조방식, 제조원 등이 같은 점, 기존 백신의 면역반응, 안전성, 국내외 시판 후 안정성 등을 종합 검토한 결과 해당 백신의 효과성과 안전성이 인정 가능하다고 의견을 모았다.
이후 식약처는 공중보건 위기대응 의료제품 안전관리·공급위원회를 개최해 긴급사용승인을 결정했다. 위원회에서는 법적 요건 충족 여부, 중앙약심 자문 결과, 동절기 예방접종을 위한 신속 도입 필요성 등을 검토·심의해 긴급사용승인이 타당하다는 결론을 냈다.
식약처 관계자는 "앞으로 긴급사용승인된 백신의 품질이 확보될 수 있도록 철저히 관리하고 사용 과정에서 부작용 정보 수집 등 안전한 사용을 위한 추가적인 조치에 더욱 힘쓰겠다"며 "관계 부처와 협력해 접종 후 이상사례에 대한 감시체계를 강화하고 철저한 모니터링과 신속한 대응으로 국민이 안심하고 접종받을 수 있도록 최선을 다 하겠다"고 했다.
kh99@newspim.com
 영상
영상