[세종=뉴스핌] 신도경 기자 = 세포기반 인공혈액이 첨단바이오의약품으로 분류돼 임상시험 진입, 품목허가 신청 등이 가능해졌다.
식품의약품안전처는 국가 연구개발(R&D)로 개발하고 있는 세포기반 인공혈액을 첨단바이오의약품으로 분류해 임상시험 진입, 품목허가 신청 등 향후 개발 과정의 본격적인 진행이 가능해졌다고 8일 밝혔다.
국가 R&D 사업인 세포 기반 인공혈액 기술개발 사업은 저출생·고령화와 감염병 발생으로 혈액 공급난 대비를 위해 줄기세포로부터 적혈구, 혈소판을 생산하고 상용화하는 기술 확보를 목표로 한다.
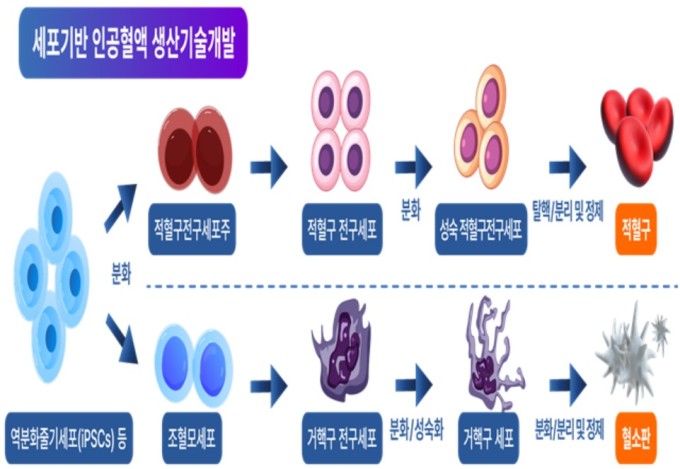 |
| [자료=식품의약품안전처] 2025.08.08 sdk1991@newspim.com |
세포기반 인공혈액은 세계적으로 제품화 사례가 없는 신개념 제품으로 가이드라인 등 규제 체계가 미비한 상황이다. 국내 '혈액관리법'은 인체에서 채혈한 혈구 및 혈장만을 '혈액'으로 규정해 안전성과 효과성 평가 방법 등 제품화를 위한 규제 요건이 불명확한 상황이었다.
식약처는 지난해부터 규제정합성 검토 제도를 통해 개발 초기 단계부터 제품화에 필요한 규제 요건 등 컨설팅을 제공해 왔다. 제품의 사용 목적, 형태, 작용 기전 등을 종합적으로 검토해 세포 기반 인공혈액을 첨단바이오의약품으로 분류하기로 했다.
이번 품목분류에 따라 세포기반 인공혈액은 임상시험 진입, 허가 신청 등이 가능해졌다. 향후 개발 과정이 정상적으로 완료되면 헌혈 혈액을 대체뿐 아니라 희귀혈액형, 혈소판 감소증 환자 등 특수 수요에도 대응할 수 있다.
식약처는 "인공혈액 외에도 발달장애 디지털치료기기, 유전자치료제, AI 헬스케어 등 식의약 혁신제품 개발 국가 R&D에 대한 규제 정합성 검토를 확대하고 있다"며 "첨단·혁신 기술의 가치가 제품화를 통해 국민께 신속히 전달될 수 있도록 적극 지원할 계획"이라고 설명했다.
sdk1991@newspim.com
 영상
영상




